En producción y vida útil, el gel de sílice se puede utilizar para secar N2, aire, hidrógeno, gas natural [1], etc.Según el ácido y el álcali, el desecante se puede dividir en: desecante ácido, desecante alcalino y desecante neutro [2].El gel de sílice parece ser un secador neutro que parece secar NH3, HCl, SO2, etc. Sin embargo, desde el punto de vista principal, el gel de sílice se compone de deshidratación intermolecular tridimensional de moléculas de ácido ortosilícico, el cuerpo principal es SiO2. y la superficie es rica en grupos hidroxilo (ver Figura 1).La razón por la que el gel de sílice puede absorber agua es que el grupo hidroxilo de silicio en la superficie del gel de sílice puede formar enlaces de hidrógeno intermoleculares con las moléculas de agua, por lo que puede adsorber agua y así desempeñar un papel de secado.El gel de sílice que cambia de color contiene iones de cobalto y, una vez que el agua de adsorción alcanza la saturación, los iones de cobalto en el gel de sílice que cambia de color se convierten en iones de cobalto hidratados, de modo que el gel de sílice azul se vuelve rosado.Después de calentar el gel de sílice rosa a 200 ℃ durante un período de tiempo, el enlace de hidrógeno entre el gel de sílice y las moléculas de agua se rompe, y el gel de sílice descolorido se volverá azul nuevamente, de modo que el diagrama de estructura del ácido silícico y el gel de sílice pueda reutilizarse como se muestra en la Figura 1. Entonces, dado que la superficie del gel de sílice es rica en grupos hidroxilo, la superficie del gel de sílice también puede formar enlaces de hidrógeno intermoleculares con NH3 y HCl, etc., y puede que no haya forma de actuar como un desecante de NH3 y HCl, y no existe ningún informe relevante en la literatura existente.Entonces, ¿Cuáles fueron los resultados?Este sujeto ha realizado la siguiente investigación experimental.
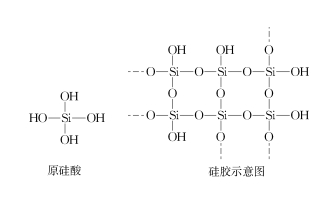
HIGO.1 Diagrama de estructura del ácido ortosilícico y gel de sílice.
2 parte del experimento
2.1 Exploración del ámbito de aplicación del desecante de gel de sílice: amoníaco Primero, el gel de sílice descolorido se colocó en agua destilada y agua con amoníaco concentrado, respectivamente.El gel de sílice descolorido se vuelve rosado en agua destilada;En el amoníaco concentrado, la silicona que cambia de color primero se vuelve roja y lentamente se vuelve azul claro.Esto muestra que el gel de sílice puede absorber NH3 o NH3 ·H2 O en amoníaco.Como se muestra en la Figura 2, el hidróxido de calcio sólido y el cloruro de amonio se mezclan uniformemente y se calientan en un tubo de ensayo.El gas resultante se elimina con cal alcalina y luego con gel de sílice.El color del gel de sílice cerca de la dirección de entrada se vuelve más claro (se explora el color del ámbito de aplicación del desecante de gel de sílice en la Figura 2: amoníaco 73, la octava fase de 2023 es básicamente el mismo que el color del gel de sílice empapado en agua concentrada con amoníaco), y el papel de prueba de pH no tiene cambios obvios.Esto indica que el NH3 producido no ha llegado al papel de prueba de pH y ha sido completamente adsorbido.Después de un período de tiempo, detenga el calentamiento, saque una pequeña parte de la bola de gel de sílice, póngala en agua destilada, agregue fenolftaleína al agua, la solución se vuelve roja, lo que indica que el gel de sílice tiene un fuerte efecto de adsorción en NH3, después de que se desprende el agua destilada, el NH3 ingresa al agua destilada, la solución es alcalina.Por lo tanto, debido a que el gel de sílice tiene una fuerte adsorción de NH3, el agente secante de silicona no puede secar el NH3.
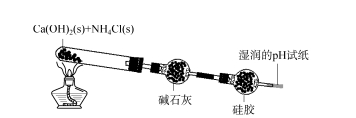
HIGO.2 Exploración del ámbito de aplicación del desecante de gel de sílice: amoníaco
2.2 Exploración del ámbito de aplicación del desecante de gel de sílice: el cloruro de hidrógeno primero quema los sólidos de NaCl con la llama de una lámpara de alcohol para eliminar el agua húmeda de los componentes sólidos.Después de enfriar la muestra, se agrega ácido sulfúrico concentrado a los sólidos de NaCl para producir inmediatamente una gran cantidad de burbujas.El gas generado se pasa a un tubo de secado esférico que contiene gel de sílice y se coloca un papel de prueba de pH húmedo en el extremo del tubo de secado.El gel de sílice en el extremo frontal se vuelve verde claro y el papel de prueba de pH húmedo no presenta cambios obvios (consulte la Figura 3).Esto muestra que el gas HCl generado es completamente absorbido por el gel de sílice y no escapa al aire.
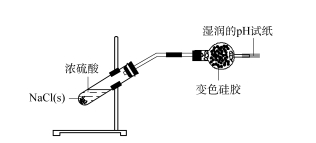
Figura 3 Investigación sobre el ámbito de aplicación del desecante de gel de sílice: cloruro de hidrógeno
El gel de sílice absorbió HCl y se volvió verde claro y se colocó en un tubo de ensayo.Coloque el nuevo gel de sílice azul en el tubo de ensayo, agregue ácido clorhídrico concentrado, el gel de sílice también adquiere un color verde claro, los dos colores son básicamente iguales.Esto muestra el gas de gel de sílice en el tubo de secado esférico.
2.3 Exploración del ámbito de aplicación del desecante de gel de sílice: dióxido de azufre Ácido sulfúrico concentrado mixto con tiosulfato de sodio sólido (ver Figura 4), NA2s2 O3 +H2 SO4 ==Na2 SO4 +SO2 ↑+S↓+H2 O;El gas generado pasa a través del tubo de secado que contiene el gel de sílice descolorido, el gel de sílice descolorido se vuelve azul verdoso claro y el papel tornasol azul al final del papel de prueba húmedo no cambia significativamente, lo que indica que el gas SO2 generado tiene Ha sido completamente absorbido por la bola de gel de sílice y no puede escapar.
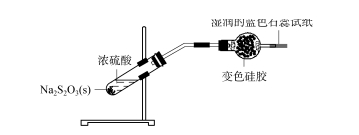
HIGO.4 Exploración del ámbito de aplicación del desecante de gel de sílice: dióxido de azufre
Quita una parte de la bola de gel de sílice y ponla en agua destilada.Después del equilibrio completo, coloque una pequeña cantidad de agua en el papel tornasol azul.El papel de prueba no cambia significativamente, lo que indica que el agua destilada no es suficiente para desorber el SO2 del gel de sílice.Toma una pequeña parte de la bola de gel de sílice y caliéntala en el tubo de ensayo.Coloque papel tornasol azul húmedo en la boca del tubo de ensayo.El papel tornasol azul se vuelve rojo, lo que indica que el calentamiento hace que el gas SO2 se desorba de la bola de gel de sílice, lo que hace que el papel tornasol se vuelva rojo.Los experimentos anteriores muestran que el gel de sílice también tiene un fuerte efecto de adsorción sobre SO2 o H2 SO3 y no puede usarse para secar gas SO2.
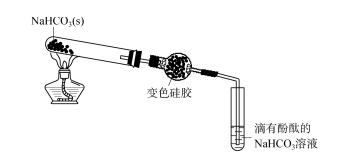
2.4 Exploración del ámbito de aplicación del desecante de gel de sílice. Dióxido de carbono.
Como se muestra en la Figura 5, la solución de bicarbonato de sodio que gotea fenolftaleína aparece de color rojo claro.El sólido de bicarbonato de sodio se calienta y la mezcla de gases resultante se pasa a través de un tubo de secado que contiene esferas de gel de sílice secas.El gel de sílice no cambia significativamente y el bicarbonato de sodio que gotea con fenolftaleína adsorbe el HCl.El ion cobalto en el gel de sílice descolorido forma una solución verde con Cl- y gradualmente se vuelve incoloro, lo que indica que hay un complejo de gas CO2 al final del tubo de secado esférico.El gel de sílice de color verde claro se coloca en agua destilada y el gel de sílice descolorido cambia gradualmente a amarillo, lo que indica que el HCl adsorbido por el gel de sílice se ha desorbido en el agua.Se añadió una pequeña cantidad de la solución acuosa superior a la solución de nitrato de plata acidificada con ácido nítrico para formar un precipitado blanco.Se deja caer una pequeña cantidad de solución acuosa sobre una amplia gama de papel de prueba de pH y el papel de prueba se vuelve rojo, lo que indica que la solución es ácida.Los experimentos anteriores muestran que el gel de sílice tiene una fuerte adsorción al gas HCl.El HCl es una molécula fuertemente polar, y el grupo hidroxilo en la superficie del gel de sílice también tiene una fuerte polaridad, y los dos pueden formar enlaces de hidrógeno intermoleculares o tener una interacción dipolo-dipolo relativamente fuerte, lo que resulta en una fuerza intermolecular relativamente fuerte entre la superficie de la sílice. moléculas de gel y HCl, por lo que el gel de sílice tiene una fuerte adsorción de HCl.Por lo tanto, el agente secante de silicona no se puede utilizar para secar el escape de HCl, es decir, el gel de sílice no adsorbe CO2 o sólo adsorbe parcialmente CO2.
HIGO.5 Exploración del ámbito de aplicación del desecante de gel de sílice: dióxido de carbono
Para probar la adsorción de gel de sílice en gas dióxido de carbono, se continúan los siguientes experimentos.Se retiró la bola de gel de sílice del tubo de secado esférico y la parte se dividió en una solución de bicarbonato de sodio goteando fenolftaleína.La solución de bicarbonato de sodio se decoloró.Esto muestra que el gel de sílice adsorbe dióxido de carbono y, una vez soluble en agua, el dióxido de carbono se desorbe en una solución de bicarbonato de sodio, lo que hace que la solución de bicarbonato de sodio se desvanezca.La parte restante de la bola de silicona se calienta en un tubo de ensayo seco y el gas resultante se pasa a una solución de bicarbonato de sodio que gotea con fenolftaleína.Pronto, la solución de bicarbonato de sodio cambia de rojo claro a incolora.Esto también muestra que el gel de sílice todavía tiene capacidad de adsorción de gas CO2.Sin embargo, la fuerza de adsorción del gel de sílice sobre el CO2 es mucho menor que la del HCl, NH3 y SO2, y el dióxido de carbono sólo puede adsorberse parcialmente durante el experimento de la Figura 5. Es probable que la razón por la que el gel de sílice puede adsorber parcialmente el CO2 sea que el gel de sílice y el CO2 forman enlaces de hidrógeno intermoleculares Si — OH… O =C.Debido a que el átomo de carbono central del CO2 es un híbrido sp y el átomo de silicio en el gel de sílice es un híbrido sp3, la molécula lineal de CO2 no coopera bien con la superficie del gel de sílice, lo que da como resultado que la fuerza de adsorción del gel de sílice sobre el dióxido de carbono sea relativamente pequeño.
3. Comparación entre la solubilidad de los cuatro gases en agua y el estado de adsorción en la superficie del gel de sílice. De los resultados experimentales anteriores, se puede ver que el gel de sílice tiene una fuerte capacidad de adsorción de amoníaco, cloruro de hidrógeno y dióxido de azufre, pero una pequeña fuerza de adsorción para el dióxido de carbono (ver Tabla 1).Esto es similar a la solubilidad de los cuatro gases en agua.Esto puede deberse a que las moléculas de agua contienen hidroxi-OH y la superficie del gel de sílice también es rica en hidroxilo, por lo que la solubilidad de estos cuatro gases en agua es muy similar a su adsorción en la superficie del gel de sílice.Entre los tres gases de amoníaco, cloruro de hidrógeno y dióxido de azufre, el dióxido de azufre tiene la menor solubilidad en agua, pero después de ser adsorbido por gel de sílice, es el más difícil de desorcionar entre los tres gases.Después de que el gel de sílice adsorbe el amoníaco y el cloruro de hidrógeno, se puede desorber con agua solvente.Una vez que el gas de dióxido de azufre es absorbido por el gel de sílice, es difícil desorcionarlo con agua y debe calentarse hasta la desorción de la superficie del gel de sílice.Por tanto, se debe calcular teóricamente la adsorción de cuatro gases en la superficie del gel de sílice.
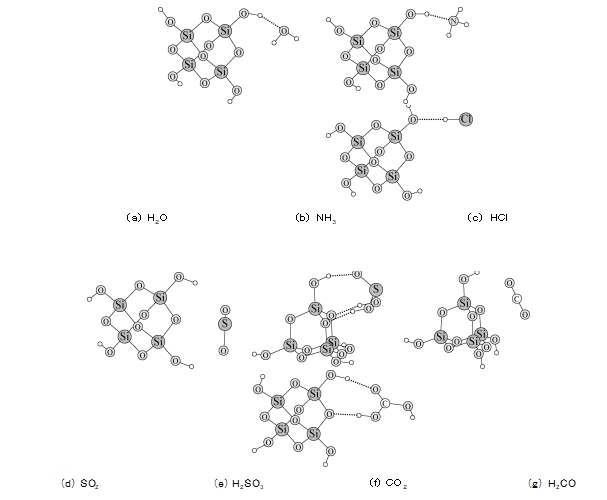
4 El cálculo teórico de la interacción entre el gel de sílice y cuatro gases se presenta en el software de cuantificación ORCA [4] bajo el marco de la teoría funcional de la densidad (DFT).Se utilizó el método DFT D/B3LYP/Def2 TZVP para calcular los modos de interacción y energías entre diferentes gases y gel de sílice.Para simplificar el cálculo, los sólidos de gel de sílice están representados por moléculas de ácido ortosilícico tetrámero.Los resultados del cálculo muestran que H2O, NH3 y HCl pueden formar enlaces de hidrógeno con el grupo hidroxilo en la superficie del gel de sílice (ver Figura 6a ~ c).Tienen una energía de unión relativamente fuerte en la superficie del gel de sílice (ver Tabla 2) y se adsorben fácilmente en la superficie del gel de sílice.Dado que la energía de unión del NH3 y el HCl es similar a la del H2O, el lavado con agua puede provocar la desorción de estas dos moléculas de gas.Para la molécula de SO2, su energía de enlace es sólo -17,47 kJ/mol, que es mucho menor que la de las tres moléculas anteriores.Sin embargo, el experimento confirmó que el gas SO2 se absorbe fácilmente en el gel de sílice, e incluso el lavado no puede desorberlo, y sólo el calentamiento puede hacer que el SO2 escape de la superficie del gel de sílice.Por lo tanto, supusimos que es probable que el SO2 se combine con el H2 O en la superficie del gel de sílice para formar fracciones de H2 SO3.La Figura 6e muestra que la molécula de H2 SO3 forma tres enlaces de hidrógeno con los átomos de hidroxilo y oxígeno en la superficie del gel de sílice al mismo tiempo, y la energía de enlace es tan alta como -76,63 kJ/mol, lo que explica por qué el SO2 se adsorbe en El gel de sílice es difícil de eludir con agua.El CO2 no polar tiene la capacidad de unión más débil con el gel de sílice y solo puede ser absorbido parcialmente por el gel de sílice.Aunque la energía de unión del H2 CO3 y el gel de sílice también alcanzó -65,65 kJ/mol, la tasa de conversión de CO2 en H2 CO3 no fue alta, por lo que la tasa de adsorción de CO2 también se redujo.De los datos anteriores se puede ver que la polaridad de la molécula de gas no es el único criterio para juzgar si puede ser adsorbida por el gel de sílice, y el enlace de hidrógeno formado con la superficie del gel de sílice es la razón principal de su adsorción estable.
La composición del gel de sílice es SiO2·nH2 O, la enorme superficie del gel de sílice y el rico grupo hidroxilo en la superficie hacen que el gel de sílice se pueda usar como un secador no tóxico con un rendimiento excelente y se use ampliamente en la producción y la vida. .En este artículo, se confirma a partir de dos aspectos de experimentos y cálculos teóricos que el gel de sílice puede adsorber NH3, HCl, SO2, CO2 y otros gases a través de enlaces de hidrógeno intermoleculares, por lo que el gel de sílice no se puede utilizar para secar estos gases.La composición del gel de sílice es SiO2·nH2 O, la enorme superficie del gel de sílice y el rico grupo hidroxilo en la superficie hacen que el gel de sílice se pueda usar como un secador no tóxico con un rendimiento excelente y se use ampliamente en la producción y la vida. .En este artículo, se confirma a partir de dos aspectos de experimentos y cálculos teóricos que el gel de sílice puede adsorber NH3, HCl, SO2, CO2 y otros gases a través de enlaces de hidrógeno intermoleculares, por lo que el gel de sílice no se puede utilizar para secar estos gases.
3
HIGO.6 modos de interacción entre diferentes moléculas y la superficie del gel de sílice calculados mediante el método DFT
Hora de publicación: 14-nov-2023